MDR – UDI Gereklilikleri (EK VI – Part C)

11 Kasım, 2021
Güncellenme 2023
MDR – UDI Gereklilikleri
UDI Nedir?
Benzersiz Cihaz Tanımlayıcısı (UDI), küresel olarak kabul edilen bir cihaz tanımlama ve kodlama standardı aracılığıyla oluşturulan bir dizi sayısal veya alfasayısal karakterdir. Piyasadaki belirli bir cihazın açık bir şekilde tanımlanmasını sağlar.
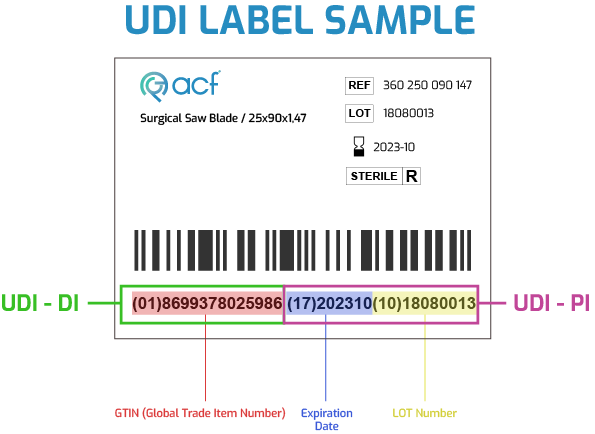
UDI, UDI-DI ve UDI-PI‘den oluşur.
Ancak cerrahi testere bıçaklar gibi tek kullanımlık cihazlar veya cerrahi motorlar, delici, kesici ve oyucu gibi yeniden kullanılabilir cihazlar için MDR UDI gereklilikleri nelerdir?
Bu UDI ataması ile, piyasaya arz sonrası faaliyetler konusunda yetkili merciler arasında daha hızlı veri alışverişi sağlanması amaçlanmaktadır.
UDI-DI ve UDI-PI nedir?
UDI-DI, bir cihaz modeline özgü benzersiz bir sayısal veya alfanümerik koddur ve aynı zamanda bir UDI veritabanında depolanan bilgilere “erişim anahtarı” olarak kullanılır.
UDI-PI, cihaz üretim birimini tanımlayan sayısal veya alfasayısal bir koddur.
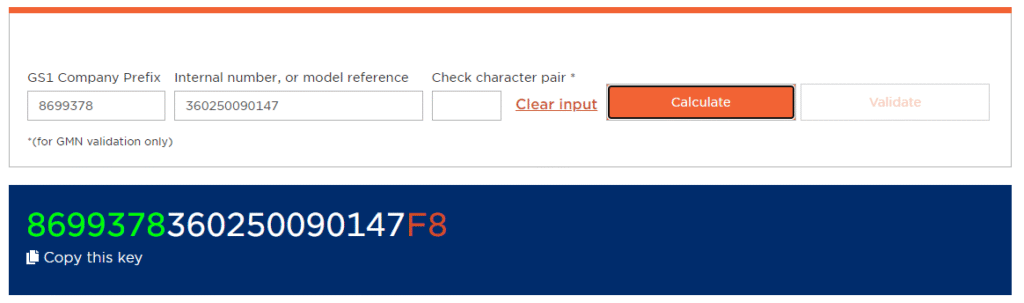
Temel UDI (Küresel Model Numarası – GMN) Nedir ve Nasıl Yapılır?
Temel UDI-DI, bir cihaz modelinin birincil tanımlayıcısıdır.
GS1, HIBCC, ICCBBA ve IFA GmbH komisyon tarafından belirlenen barkod kuruluşlarıdır. UDI’leriniz için bir organizasyon seçebilirsiniz.
GS1 ile barkod organizasyonu olarak çalışmayı düşünüyorsanız, satın aldığınız şirket ön eki ile birlikte web sitesindeki GMN oluşturucuyu kullanarak bir Temel UDIoluşturabilirsiniz.
Hangi barkod organizasyonu ile çalışmalıyız?
Tüm barkod organizasyonları aynı prensipte çalışsa daGS1 şu an için dünyanın en çok tercih edilen organizasyonu gibi görünüyor.
GS1 Barkodlarını Nasıl Kullanırım?
GS1’in web sitesine gidin ve bulunduğunuz ülkeyi bulun ve iletişime geçin.
Temel UDI-DI’ de başvurulan belgeler;
- Teknik Dokümantasyon (Onaylanmış Kuruluşa sağlanan uygunluk değerlendirme uygulaması)
- AB Uygunluk Beyanı
- Ürün Sertifikası
-AB Teknik Dokümantasyon değerlendirme sertifikası
-AB tip inceleme sertifikası
-AB ürün doğrulama sertifikası
- Serbest satış belgesi
- Tıbbi Cihazlar için Güvenlik ve Klinik Performans Özeti (SSCP)/ IVD’ler için Güvenlik ve Performans Özeti (SSP)
- Teyakkuz ve Piyasa Sonrası Gözetim Raporları (form çevrimiçi olarak doldurulursa EUDAMED’de otomatik olarak doldurulur):
-Üretici Olay Raporlama formu (MIR)
-Periyodik Özet Güncelleme Raporu (PSUR)
-Saha Güvenliği Düzeltici Faaliyet Raporlama formu (FSCAR formu)
-Periyodik Özet Rapor formu (PSR)
-Trend Raporlama formu
Genel Gereklilikler
MDD’deki gibi etiketleme ve sembol yerleştirme ile devam edeceksiniz. UDI’nin ek bir gereklilik olduğunu unutmayın.
Burada dikkate alınması gereken en önemli şey, UDI’yi atayan ve sürdüren ve UDI’lerini ürünlerine yerleştiren tek ekonomik operatör, üreticidir.
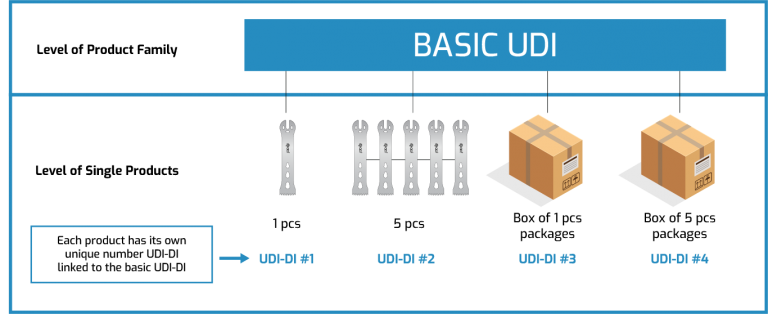
UDI
Daha yüksek ambalaj seviyeleri kendi UDI’lerine sahip olacaktır. Kısaca söylemek gerekirse, ürünü her fazla paketlediğinizde yeni bir UDI oluşturacaksınız.
*Nakliye konteynırları gereklilikten muaf tutulacaktır.
Bu durumdan anlamamız gereken, standart bir paketleme sistemimiz varsa bu paketlerin her birine bir UDI atamamız gerektiğidir. Ama diyelim ki standart bir ambalajımız yok. Ürünü tek tek paketliyoruz ve kutudaki ürün sayısı müşterinin isteğine göre her zaman farklı oluyor. Bu durumda sadece tek pakete bir UDI atamak yeterli olacaktır.
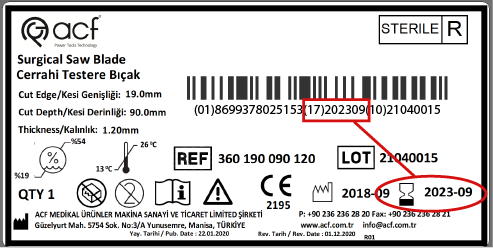
Ürününüzün raf ömrü yoksa UDI’ye üretim tarihini yazmalısınız.
Son kullanma tarihi olan bir tıbbi cihaz için sadece son kullanma tarihi yazılmalıdır.

Cihazın yanlış tanımlanmasına ve/veya izlenebilirliğinde belirsizliğe yol açabilecek bir değişiklik olduğunda yeni bir UDI-DI gerekli olacaktır; özellikle, aşağıdaki UDI veritabanı veri öğelerinden herhangi birinde yapılacak herhangi bir değişiklik, yeni bir UDI-DI gerektirecektir:
(a) isim veya ticaret unvanı,
(b) cihaz versiyonu veya modeli,
(c) tek kullanımlık olarak etiketlenmiş,
(d) steril paketlenmiş,
(e) kullanımdan önce sterilizasyon ihtiyacı,
(f) bir pakette sağlanan cihazların miktarı,
(g) kritik uyarılar veya kontrendikasyonlar: örn. lateks veya DEHP içeren
Yeniden Kullanılabilir Cihazlar için UDI Nasıl Atanır?
Temizleme, sterilizasyon gibi işlemler gerektiren hastadan hastaya tekrar kullanılabilen bir cihaz üretiyorsanız, UDI’nizi doğrudan cihaz üzerinde işaretlemeniz gerekir. Bu UDI’nin kalıcı olduğundan ve her zaman okunabilir olduğundan emin olmanız gerekir.
Cerrahi deliciler ve kesiciler tekrar kullanılabilir cihazlar olduğundan tekrar yıkanıp sterilize edilmeleri gerekir. Bu nedenle, UDI’lerinin kalıcı ve okunabilir olması gerekir.

UDI için son tarih nedir?
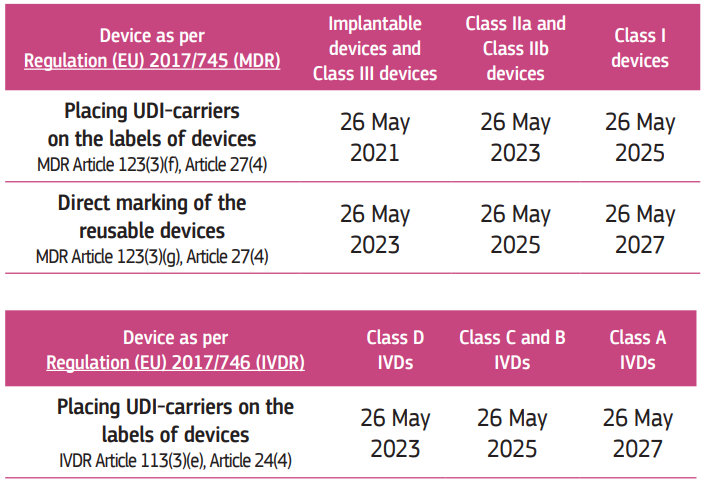
Sınıf III ve implante edilebilir cihazların her zamanki gibi daha hızlı ve daha sistematik bir şekilde ilerlemesi gerekiyor.
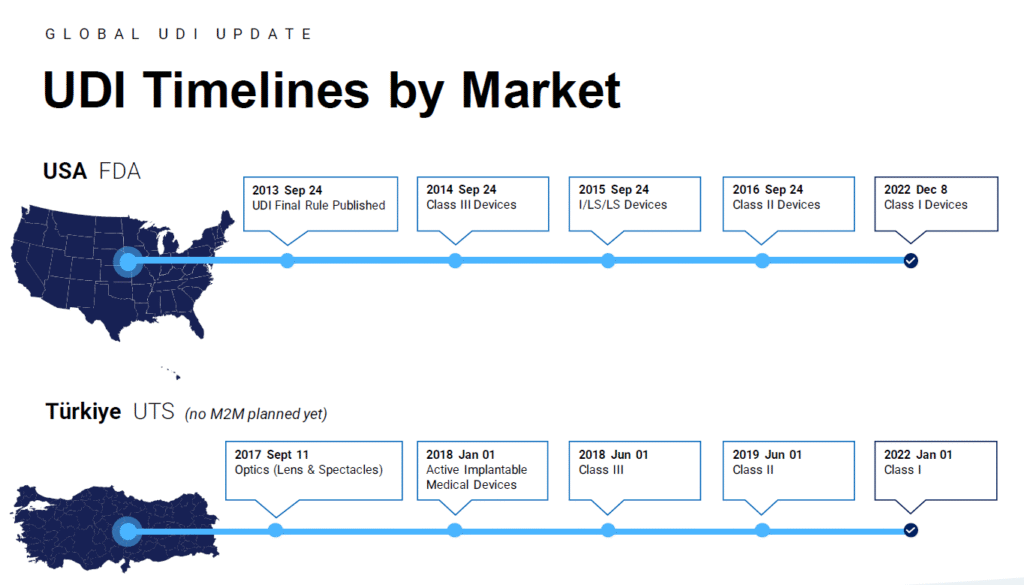
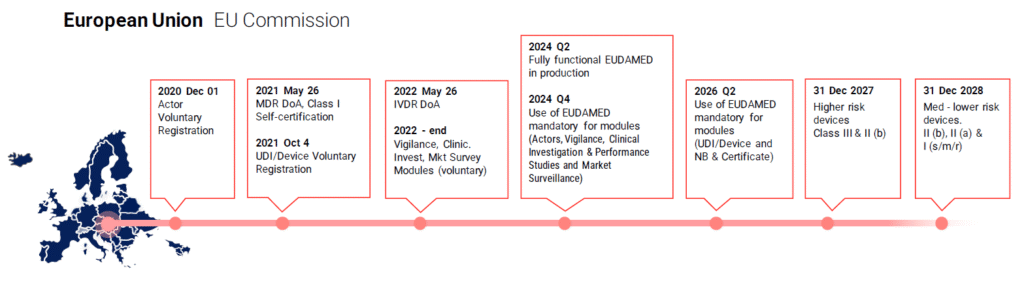
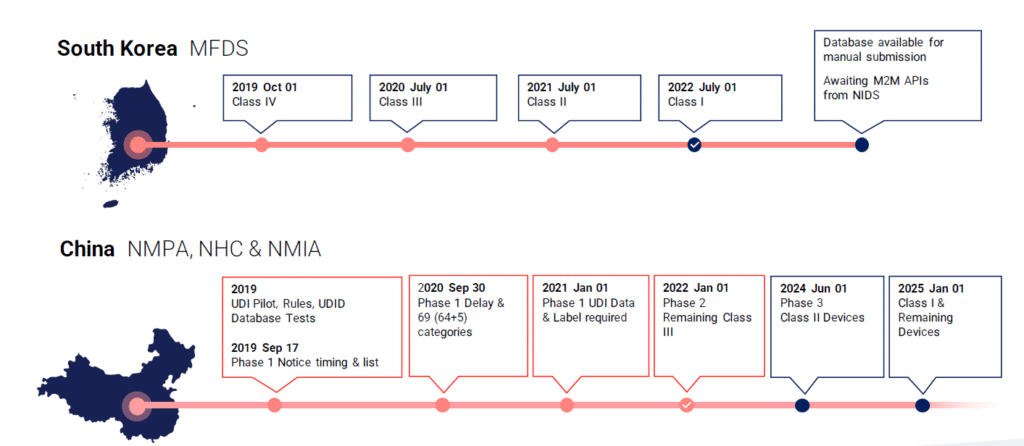
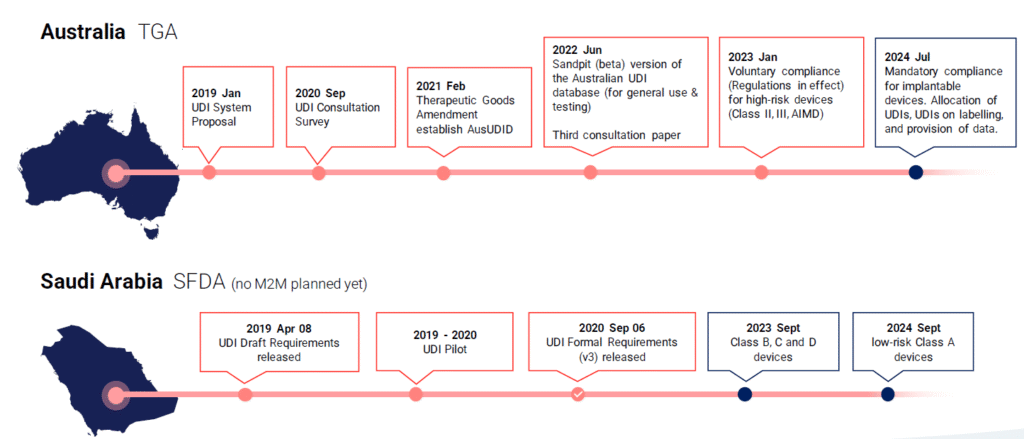
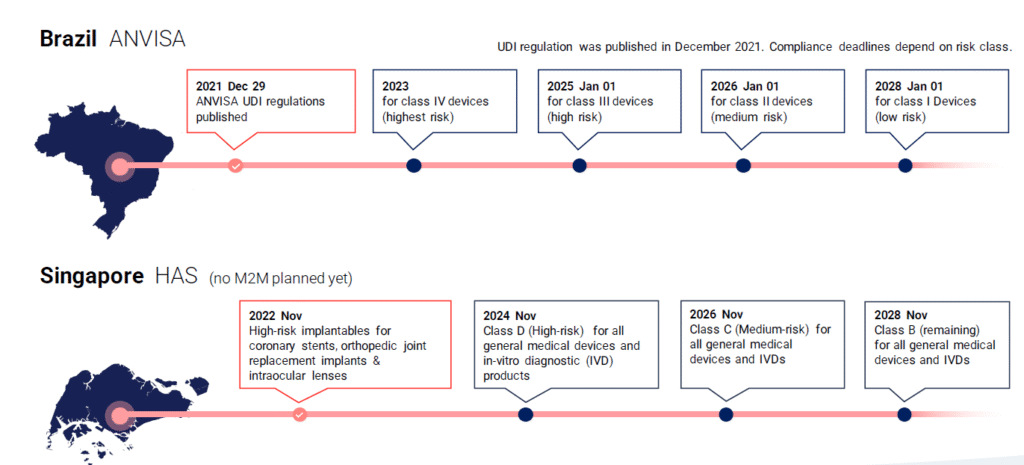
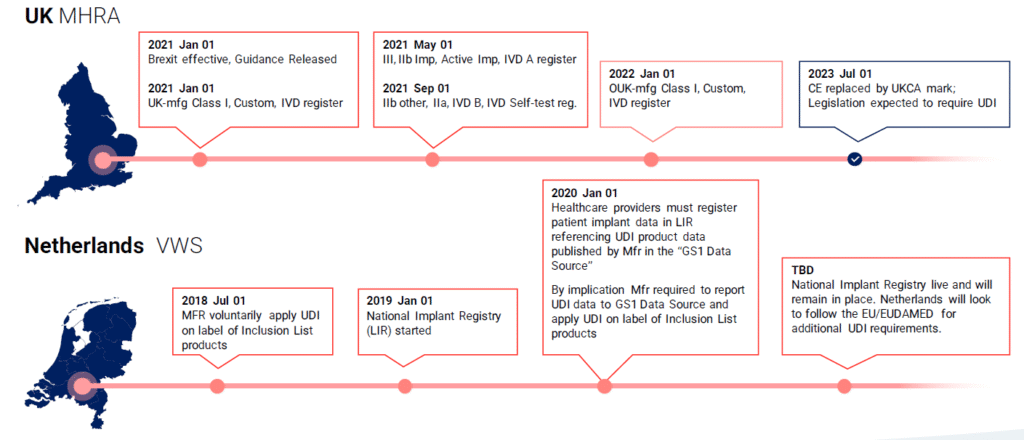
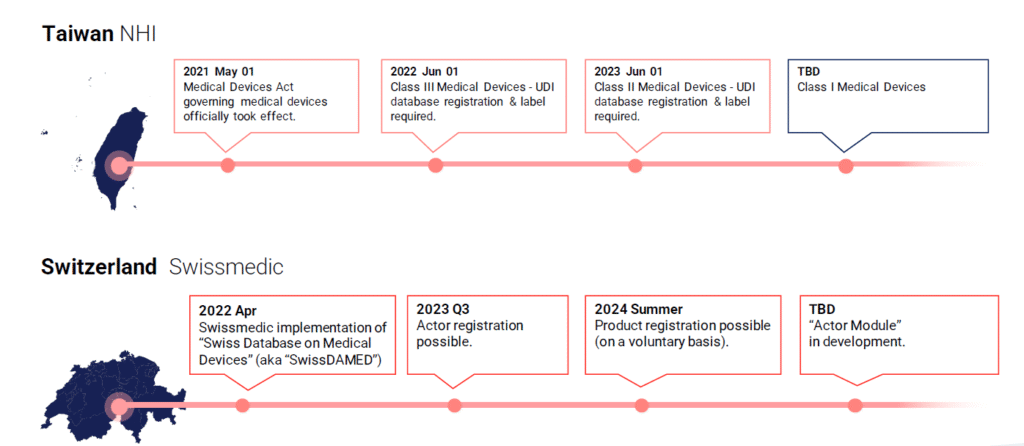
Globalde UDI Zaman Çizelgesi
MDCG 2021-19 – Guidance note integration of the UDI within an organisation’s quality management system
MDCG 2021-10 – The status of Appendixes E-I of IMDRF N48 under the EU regulatory framework for medical devices
MDCG 2021-09 – MDCG Position Paper on the Implementation of UDI requirements for contact lenses, spectacle frames, spectacle lenses & ready readers
MDCG 2018-1 Rev. 4 Guidance on basic UDI-DI and changes to UDI-DI
MDCG 2020-18 – MDCG Position Paper on UDI assignment for Spectacle lenses & Ready readers
MDCG 2019-2 – Guidance on application of UDI rules to device-part of products referred to in article 1(8), 1(9) and 1(10) of Regulation 745/2017
MDCG 2019-1 – MDCG guiding principles for issuing entities rules on basic UDI-DI
MDCG 2018-7 – Provisional considerations regarding language issues associated with the UDI database
MDCG 2018-6 – Clarifications of UDI related responsibilities in relation to article 16
MDCG 2018-5 – UDI assignment to medical device software
MDCG 2018-4 – Definitions/descriptions and formats of the UDI core elements for systems or procedure packs
MDCG 2018-3 Rev.1 – Guidance on UDI for systems and procedure packs
MDCG 2018-2 – Future EU medical device nomenclature – Description of requirements
